En introduktion til klinisk forskning
Klinisk forskning er gavnligt – for patienter, for sundhedssektoren, for lægemiddelindustrien og for samfundet som helhed. Men mange er måske ikke helt sikker på, hvad kliniske forsøg egentlig går ud på, hvem der laver dem og hvordan, og hvorfor det er så vigtigt at have klinisk forskning her i Danmark.
Det kan du lære mere om her.
Hvad er klinisk forskning egentlig?
Klinisk forskning er en disciplin hvor lægemidler undersøges og afprøves i praksis på mennesker. Klinisk forskning foregår efter, at lægemidler først er grundigt undersøgt i laboratorium og senere afprøvet på dyr. Hvis lægemidlet i disse forsøg har vist lovende resultater og acceptable bivirkninger, kan det godkendes til kliniske forsøg i mennesker.
De kliniske forsøg laves altså for at finde ud af, hvordan et lægemiddel virker, hvilke bivirkninger lægemidlet har, og hvordan det omsættes i kroppen.
Kliniske forsøg foretages ikke kun med lægemidler i gængs forstand. Forsøgene kan for eksempel være forebyggelsesforsøg der afprøver nye måder at forebygge sygdom, eller det kan være diagnostiske forsøg, der undersøger eller sammenligner nye tests eller procedurer.
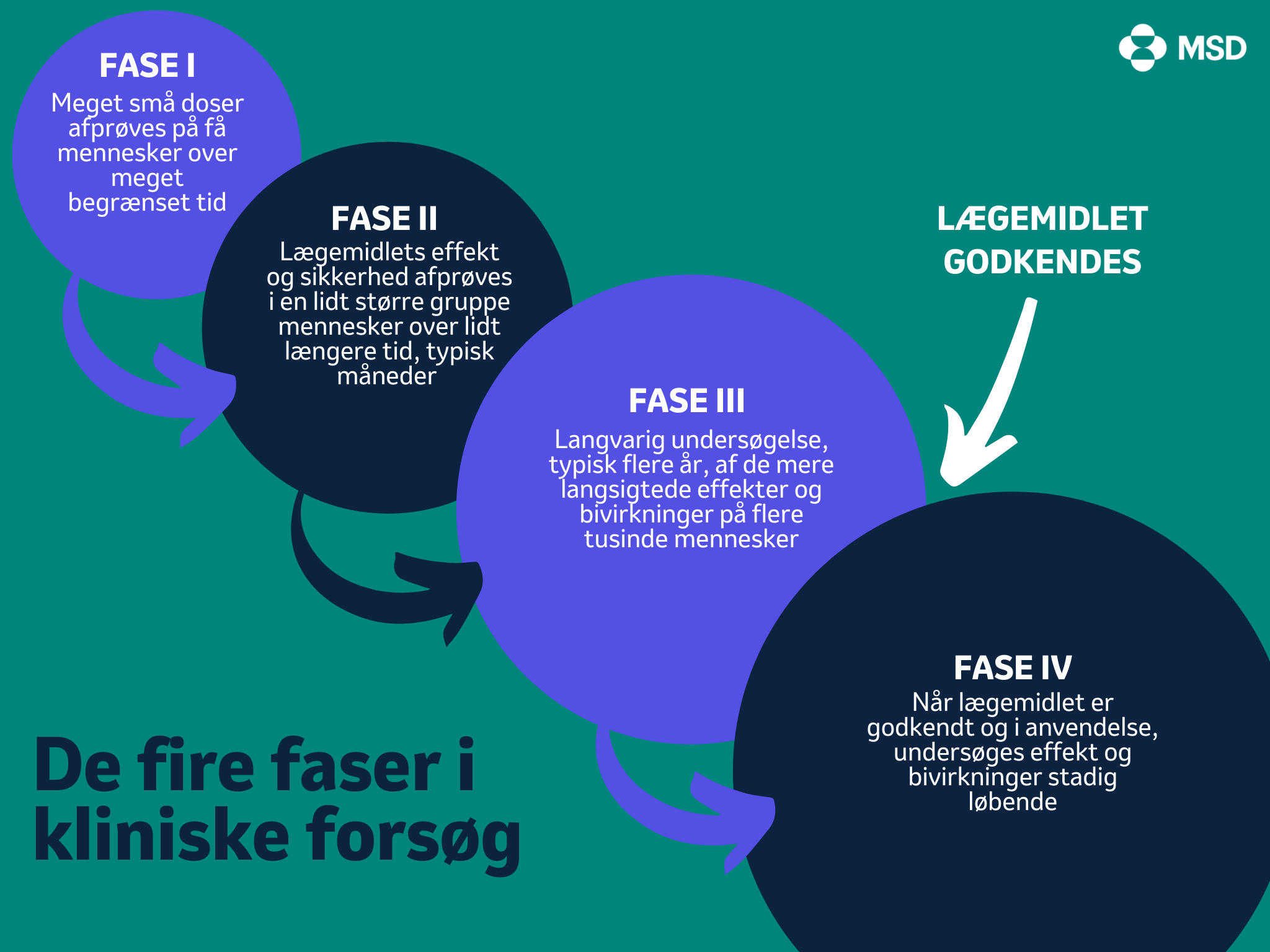
Kliniske forsøg består af fire faser, hvor der i hvert fase gradvist skrues op for antal deltagere og for perioden hvori lægemidlet indtages eller gives. Det gør man for at undersøge lægemidlets sikkerhed, effekt og bivirkninger. Det er en grundig og langvarig proces, og det tager normalt mange år, fra man påbegynder såkaldte fase I studier til at lægemidlet godkendes efter fase III studier og fase IV betragtes afsluttet.
Hvem har gavn af klinisk forskning?
Kliniske forsøg betyder, at vi konstant kan udvikle og forbedre den måde vi forebygger, diagnosticerer og behandler sygdomme på, da resultaterne fra de kliniske forsøg er grundlaget for godkendelse af nye præparater og kliniske procedurer.
Undersøgelserne kan foregå på raske, frivillige forsøgspersoner eller på frivillige patienter. Patienter i de kliniske forsøg kan potentielt få adgang til nye lægemidler, som endnu ikke er almindeligt tilgængelige. De bliver derudover fulgt nøje, og får flere samtaler med sundhedsfagligt personale.
Der foretages kliniske forsøg indenfor alle terapiområder, men allerflest foretages på kræftområdet. Af Lægemiddelstyrelsens årsrapport fra 2021 fremgår det, at onkologien fortsat er det hyppigst forekommende terapiområde blandt ansøgninger om kliniske lægemiddelforsøg.
For kræftpatienten hvor den gængse behandling ikke har vist effekt eller patienten af andre grunde ikke kan modtage godkendt behandling, kan et klinisk forsøg måske give nyt håb. I nogle tilfælde kan lægemidlet måske endda have en positiv klinisk effekt på patienten.
Men kliniske studier kommer ikke kun patienterne til gavn. De er også med til at skabe jobs, sikre læring og stimulere innovation.
Det fremgår for eksempel af rapporten ”Værdien af kliniske forsøg i Danmark”, der er udarbejdet af Copenhagen Economics med støtte fra NEXT Partnership, Lægemiddelindustriforeningen og Invest in Denmark. Ifølge denne undersøgelse smitter de sundhedsfagliges deltagelse i studierne positivt af.
- 38% af læger svarer at de er blevet bedre af deres deltagelse i industri-initierede kliniske forsøg
- 61% af læger og sygeplejersker oplever, at deres øgede viden fra forsøg er kommet andre læger og sygeplejersker på deres egne afdelinger til gode.
Klinisk forskning kommer altså hele samfundet til gavn på forskellige måder. Men allervigtigst så er kliniske forsøg med til at sikre, at vi kan få den allerbedste forebyggelse og behandling, hurtigst muligt, hvis vi bliver syge.

Hvem laver de kliniske forsøg?
Kliniske forsøg kan være finansieret af private firmaer (kommerciel forskning), offentlige institutioner (non-kommerciel forskning) eller en kombination. Den eller dem der finansierer studiet kaldes studiets sponsor. Sponsor er ansvarlig for gennemførelsen og kvaliteten af et klinisk forsøg og skal sikre, at forsøget planlægges og udføres i overensstemmelse med god klinisk praksis, herunder at data registreres og rapporteres efter procedurer, der sikrer kvaliteten i alle forsøgets aspekter.
Forsøgene udføres på kliniske forsøgssteder, oftest på hospital eller i lægepraksis, og udføres af sundhedsfaglige personer, der er uddannet i god klinisk praksis. Den overordnede ansvarlige for studiets udførelse kaldes investigatoren. Investigatoren skal blandt andet sikre, at kildedata og registrerede data er præcise, komplette, læsbare og entydige.
Som det fremgår er kravene til kliniske forsøg mange og altid de samme, uanset hvem studiets sponsor er. For at samarbejdet mellem sponsor og investigator, som i nogle tilfælde altså kan være lægemiddelindustrien og sundhedsfaglige, skal være gennemsigtigt for alle, er der klare regler for, at sundhedspersonale skal offentliggøre deres samarbejde med industrien.
Den private lægemiddelindustri står for en ikke ubetydelig del af de kliniske forsøg. I 2022 havde industrien 410 igangværende forsøg i Danmark, og hvert år investerer lægemiddelindustrien 11,5 mia.kr. i forskning. Det svarer til 27% af al privat forskning i Danmark.
I MSD Danmark er klinisk forskning også en topprioritet, og mange af vores dygtige kollegaer på Havneholmen arbejder med netop klinisk forskning.
Klinisk forskning er altså fordelagtigt på mange niveauer. Men naturligvis særligt værdifuldt for patienter som har brug for den behandling, som de kliniske forsøg er med til at bane vejen for. Som borger – rask eller syg – har man mulighed for at indgå i kliniske forsøg, hvis man opfylder de særlige krav der opstilles til deltagere i de forskellige forsøg. Tal med din behandlende læge hvis du ønsker flere oplysninger.
DK-NON-01012 / 28.08.2024





